About iBLab iBLab について
研究内容
研究活動
私たちの研究室では、モデル駆動型とデータ駆動型のアプローチを駆使した生命科学研究を異分野融合研究の立場から進めています。2つのアプローチの長所を最大限に発揮した解析、また、各々の弱点を補える統合的なアプローチの開発にも取り組んでいます。たとえば、リアルワールドで取得されたモダリティの異なるデータを統合することで、疾患進行や治療効果を高精度かつ定量的に予測する研究を進めています。さらに、実データと統計的に同じ性質を持つシミュレーションデータを大量に生成し、さまざまなシナリオをシミュレーションにより評価することで、デジタルワールドで得られた知見をリアルワールドにフィードバックする研究にも力を入れています。リアルワールドとデジタルワールドを縦横無尽に行き来するアプローチを確立し、新しい時代の異分野融合研究を創り出しています。
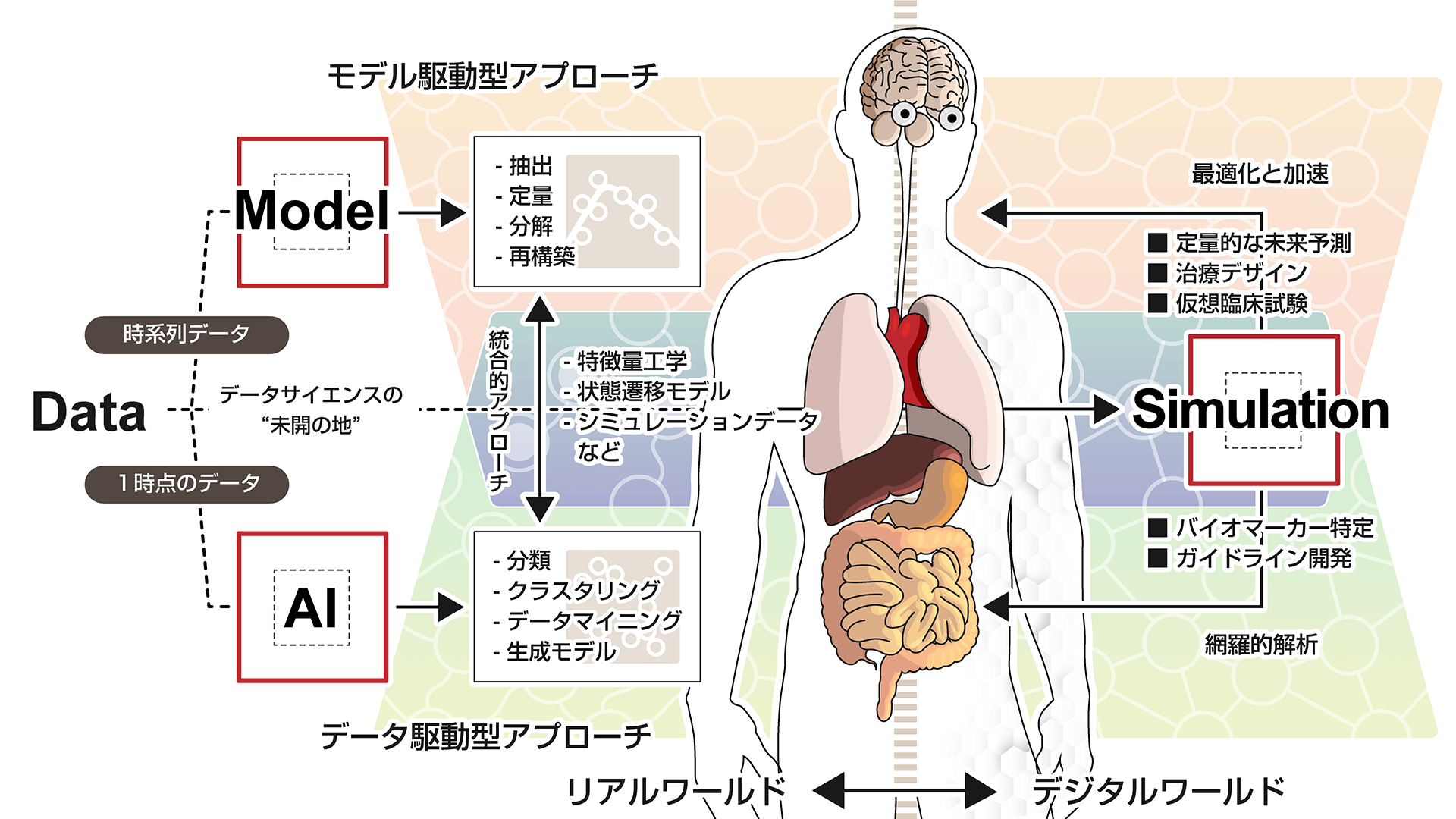
様々な階層を特徴づける定量性を持ったデータをマルチスケールに解析するための数理科学理論と計算機科学技術の開発に取り組み、生命現象に内在している恒常性とその変容・破綻をシステムとして定量的に理解・制御・操作する研究を進めています。特に注力している研究について、トピックス毎に説明します。
新型コロナウイルス感染症の研究
新型コロナウイルスによる感染症(COVID-19)が世界を震撼させています。感染者の約半数が無症状である一方で、COVID-19 患者の重症化は、発症 7−10 日目から肺炎が急速に悪化することが言われています。
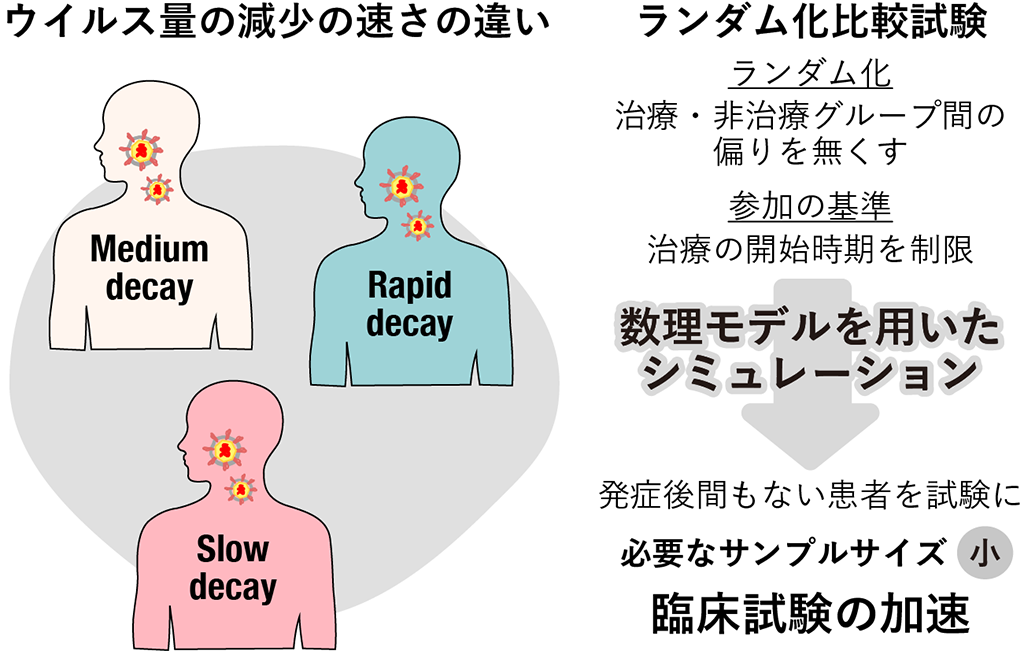
臨床の現場では、重症化を防ぐためサイトカインストームの兆候があればステロイドや抗 IL6 などが適用になりますが、いったん重症化してしまうと人工呼吸器や ECMO を用いた対処療法しか選択の余地がありません。一方で、免疫を抑制してしまうとタイミングによってはウイルスの増殖を許し病状の悪化を招くことが報告されています。従って、根本的な原因であるウイルス量を減少し、ウイルス排出期間を短縮する抗ウイルス治療の確立が希求されています。
そこで、私達のグループでは、今後も未知の感染症が流行する可能性が高いことを踏まえて、COVID-19 を含む新興感染症発生時に即時対応可能な“ウイルス非特異的”な感染動態定量化アプローチを駆使した汎用的な最適治療法提案に資するプラットフォーム開発を進めています。特に、他疾患で使用されている承認薬を用いたドラッグリポジショニングから医師主導治験へのプロセスを圧倒的に加速させることを目指した研究を進めています。
ウイルスダイナミクスの研究
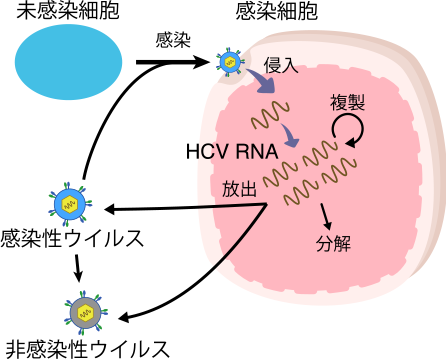
ウイルスには自身に栄養を取り込んで成長・増殖するという機能はありません。ウイルスが増殖するためには細胞の増殖機構を使う必要があることより、ウイルスは“最も単純な生命体”と比喩されることがあります。
しかし、ウイルス感染のダイナミクスを理解することはそれほど容易ではありません。現在のウイルス学では、細胞生物学的・遺伝子工学的・分子生物学的な実験技術を駆使し、感染ダイナミズムの“スナップショット”を観察することに帰着する場合が多いからです。1983 年のヒト免疫不全ウイルスの単離以降、感染ダイナミズムの全貌を理解する必要性が生じ、そのために発展してきた分野があります。ウイルスダイナミクスと呼ばれ「経時的な臨床・実験データを数理モデルやコンピュータシミュレーション、統計的手法を駆使して解析することで、時々刻々と変化する宿主内、細胞内におけるウイルス感染を定量的に理解しようとする分野」として定義されています。
私達のグループでは、イギリス、フランス、カナダ、アメリカ、オーストラリア、日本などの複数の実験および臨床チームと共同研究することで、様々な種類のウイルス感染のデータを解析しています。そして、抽出した定量的な知見に基づいて、生物学の立場からウイルス感染を理解し、制御・操作することを目指した研究を進めています。
創薬・治療最適化の研究
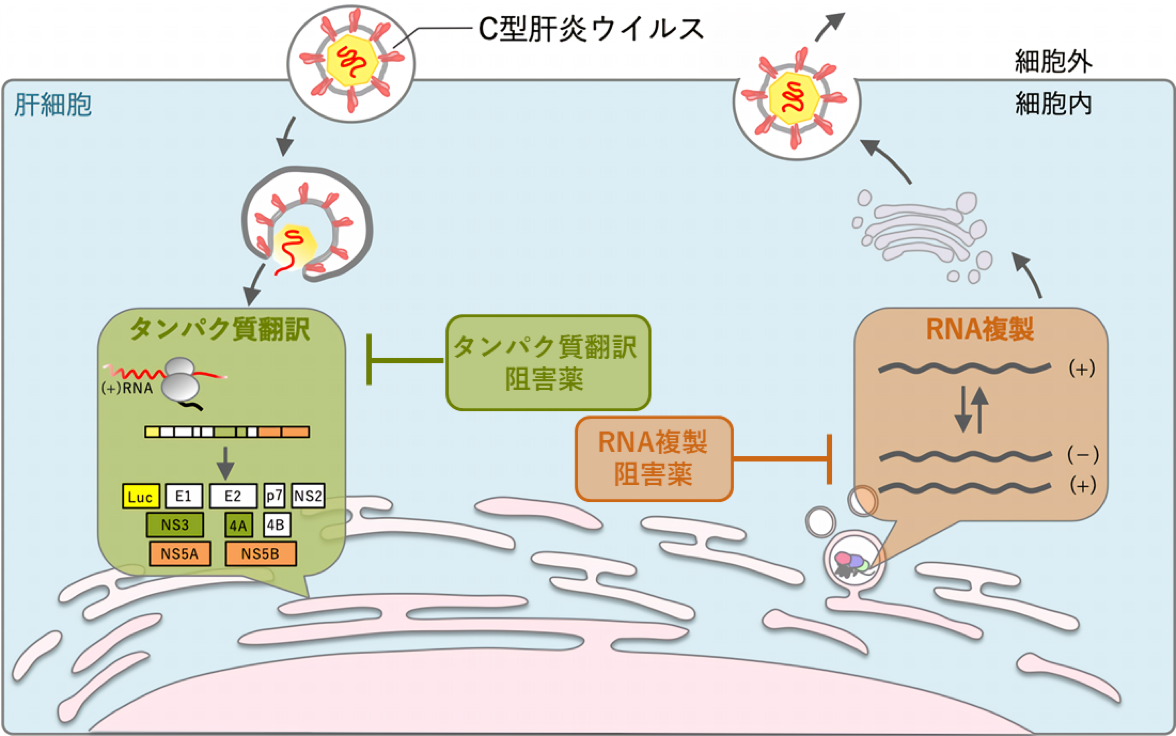
ヒト免疫不全ウイルスのように多数の薬剤組み合わせが可能な場合や C 型肝炎ウイルスの治療薬のように、ごく短期間に多くの新薬が開発された場合、個々の薬が持つ性質や特性上の相違点、最適な組み合わせ、薬剤耐性ウイルスに効果を発揮する薬剤の選択、等の深い議論がほとんど行われず、限られた組み合わせの多剤併用療法が用いられることがあります。
また、承認薬のドラッグリポジショニングでは、適用疾患への薬理作用とは異なる活性/標的分子を介するため、本来の適用の投与量、回数、治療期間は標的疾患に対して最適化されていません。もちろん、網羅的な臨床試験により再検討することで薬効をさらに増強できると期待されますが、全てのパターンを調べることは現実的ではありません。
そこで、私達のグループでは、様々な抗ウイルス効果の指標、薬剤組み合わせ理論、薬物動態学、薬力学、ウイルスダイナミクス、進化生物学を融合させたアプローチにより in silico 解析に基づいた治療最適化を進めています。さらに、莫大な費用と長い年月を要する創薬研究に、数理モデルやコンピュータシミュレーションを組み入れることで新規化合物の発見的探索を援用する試みも始めています。
免疫・細胞分化の研究
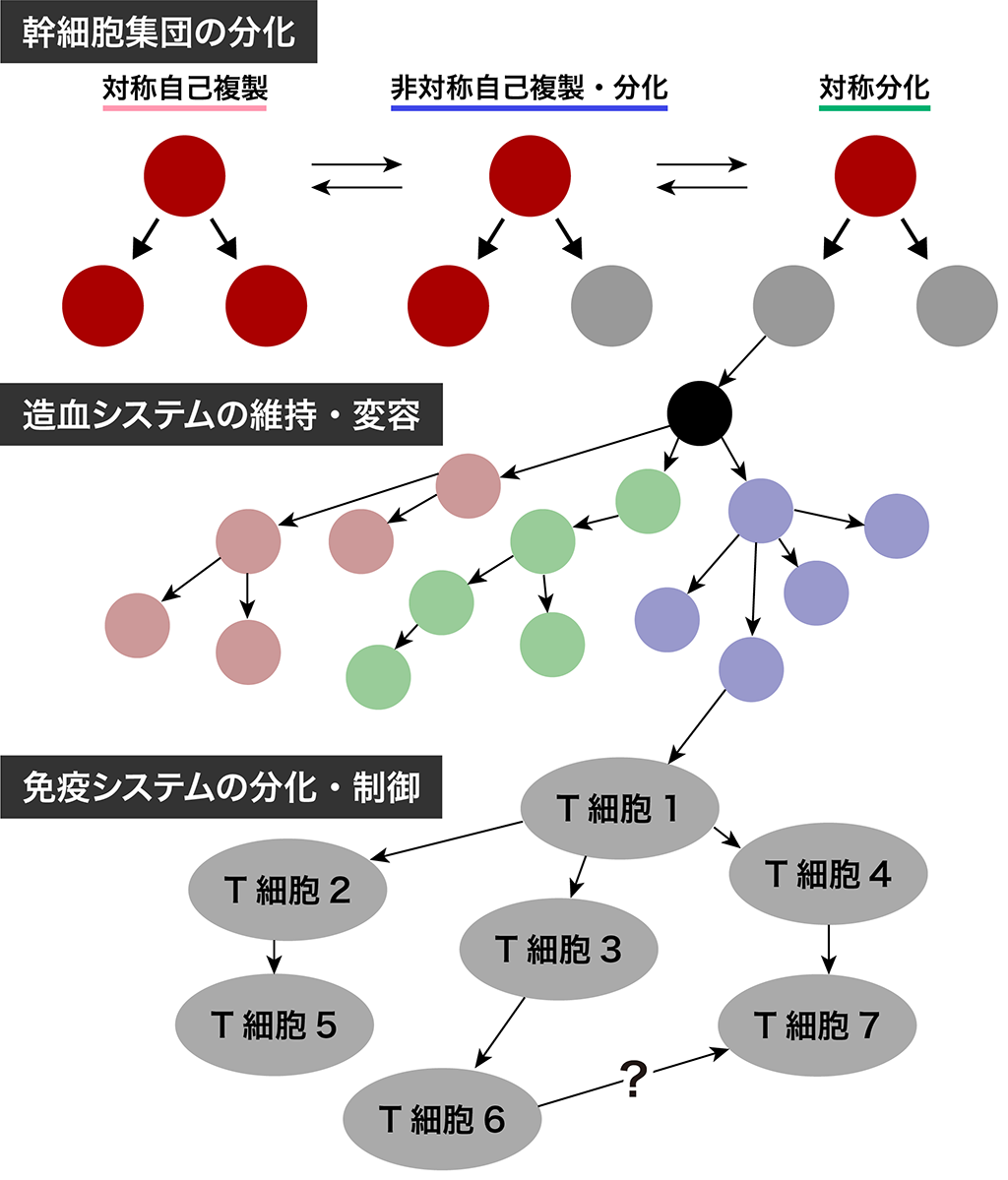
生体内の生命現象は主に細胞群のはたらきによるものです。全ての細胞は幹細胞から分化し、徐々にそれぞれの能力を獲得していくことで、一つのシステムとして機能しています。
健康な生体内では、細胞群が恒常性を保っていると考えられますが、分裂異常による細胞数の変化や、特定の細胞群の異常な働きによる炎症などのように恒常性の破綻が疾患へとつながります。細胞群の恒常性が破綻する原因には、遺伝子変異や病原体の侵入など様々な原因が考えられます。生命現象を理解するためには、細胞がどのような順番で分化し、それがどのように制御されているかを明らかにする必要があります。近年では、計測技術が発達したことで、1細胞レベルでの細胞の多様性やそれぞれの細胞の分化履歴を取得することが可能になりました。
私達のグループでは、最新の計測実験から得られるデータから、幹細胞がどのように分化と自己複製を制御し、どのような段階を経て最終的な分化細胞へと分化していくかを明らかにするための、造血幹細胞分化の数理モデルおよびコンピュータシミュレーションの開発を進めています。
さらに、造血幹細胞から作られる免疫系では、様々な機能を持った細胞が互いに制御しながら病原体の侵入に対応しています。私達は、それぞれの細胞群がどのような割合でどの細胞群に分化し、互いにどのように制御しあっているかを解明するための定量的な研究も進めております。
例えば、アレルギー発症のメカニズムを明らかにすることに役立つと考えています。最終的には、幹細胞から組織までの細胞分化を記述する理論を構築し、造血システム・免疫系以外の組織にも応用することを目指しています。
骨粗鬆症などの代謝性疾患の研究
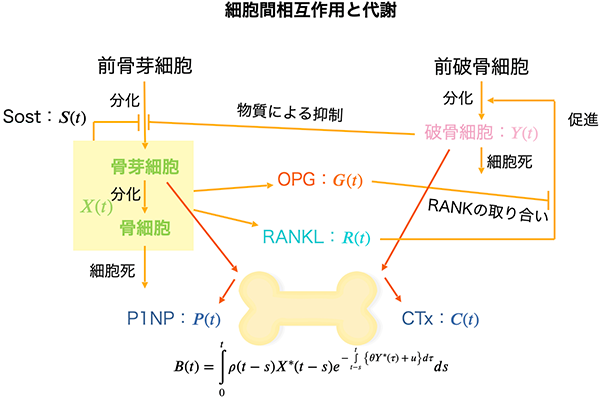
加齢や閉経、生活習慣の悪化等により骨代謝の恒常性が破綻すると、骨粗鬆症を発症します。
我が国の骨粗鬆症患者数は 1300 万人と推計(高齢者の 2、3 人に一人が罹患)され、その内、毎年 15 万人が骨折をおこし、うち 2 万人余りが死亡、6 万人が身体機能低下により要介護状態に陥るなど、骨粗鬆症は極めて高頻度かつ重篤な疾患であります。高齢者が安心して生活できる社会に向けて、高齢化社会における健康寿命を延長し、要介護者数を抑制するためにも骨粗鬆症の克服は喫緊の課題の1つです。
現在、骨粗鬆症の治療法として骨吸収を担う破骨細胞を標的とする治療法が一定の効果を上げていますが、古い骨が蓄積するために骨の強度低下により骨折してしまいます。そのため骨吸収の抑制だけではなく新たな骨の形成を促す必要がありますが、骨形成を促進する効果的かつ科学的根拠に基づいた安全な治療薬が存在しないなど、完全に骨粗鬆症が制圧されているとはいえません。従って、現状では発症を予防するもしくは早期に疾患を見つけ出し、骨量維持・増加効果のある適切な運動介入を行うことが非常に重要です。
私達のグループでは、個人の骨代謝の状態を鋭敏に反映する血中骨代謝関連マーカーに注目し、これらのマーカーの変化から発症要因の異なる骨粗鬆症であっても疾患横断的に骨量変化を予測する手法を開発しています。また、網羅的な運動条件の探索により、骨量減少あるいは増加を実現する運動プログラムを確立することを目指しています。
がん疾患の研究
わが国の死亡原因の 1 位はがんであり、例えば最も死亡者の多い肺がんであれば年間 8 万人近くが命を落としています。
近年の分子標的薬・免疫チェックポイント阻害薬を含む各種薬物療法の目覚ましい進歩により、進行がんの予後はある程度の改善がみられてきましたが、獲得耐性の出現や適用症例が限定的であるなど今なお大きな問題が多く残っています。また、国内の女性罹患数が最も高い乳がんでは、手術や放射線治療によってがん病変を取り除けた場合は予後良好である一方で、一部の症例(診断時に転移がある症例も含む)では転移・再発する可能性が高く、これらのがんの病態を明らかにし、制御することが求められています。さらに、固形がんとは対照的に、強力な薬物療法や放射線治療、造血幹細胞移植が奏効する血液がんであっても、成人 T 細胞白血病のように無治療経過観察時に発症した場合、本質的には対処療法しか選択肢のない悪性リンパ腫もあります。
私達のグループでは、ヒト個体内の様々な臓器で腫瘍が環境に適応する仕組みをシステムとして理解し、その特徴と脆弱性の定量的分析から、革新的な治療戦略を導き出すことを目指した研究を進めています。
生命医科学のデジタルトランスフォーメーション

次世代シーケンサー解析の誕生と技術革新により、ゲノム変異解析や RNA-Seq 遺伝子発現解析など様々な解析手法が確立され、さらに1細胞レベルでの変異・発現解析が可能になりました。
生命医科学研究領域では、これらの解析手法を駆使したビッグデータ利活用による新しい研究分野が台頭する時代になり、機械学習を中心としたデータ駆動型アプローチが注目を集めています。
しかし、例えば、社会が直面している感染症・がん・臓器疾患に目を向けた場合、臨床試験や医療機関から得られる高精度(経時的)医療データには制約があり、その大量取得は容易ではありません(難病や移植等の“レア症例”であれば極めて困難です)。つまり、多くの臨床データはビッグデータではないため、データ駆動型アプローチの適用がしばしば困難であると言えます。
そこで、私達のグループでは「モデル駆動型とデータ駆動型の融合」を核とした数理科学基盤を構築し、社会の喫緊課題である疾患を具体例として、数理科学による予測・精密・個別医療のパラダイムシフトに挑戦しています。